Download Pembahasan Soal Pilihan Ganda OSP Kimia 2019 PDF DOC – Alhamdulillah pelaksanaan Olimpiade Sains Nasional (OSN) tingkat Provinsi (OSP) tahun 2019 telah final dilaksanakan. Selamat untuk para akseptor yang lolos seleksi tingkat provinsi sehingga akan mewakili masing-masing provinsi di tingkat nasional tahun 2019. Untuk latihan soal pelaksanaan OSK, OSP dan OSN 2020 2021 2022 dan seterusnya, berikut ini Pembahasan Soal OSP Kimia 2019 PDF DOC pilihan ganda.
Pembahasan Soal Pilihan Ganda OSP Kimia 2019 PDF DOC
Soal OSP Kimia yang aku terima masih berupa scan PDF sehingga aku ketik ulang soal OSP Kimia 2019. Untuk pembahasan soal, aku ambil dari blog urip.info (master Kimia dan IT). Untuk memudahkan dalam memahami pembahasan soal OSP Kimia 2019 ini, aku jadikan menjadi 3 judul:
Soal dan Pembahasan OSP Kimia 2019 Nomor 1-10 klik disini
Soal dan Pembahasan OSP Kimia 2019 Nomor 11-20 klik disini
Soal dan Pembahasan OSP Kimia 2019 Nomor 20-30 klik disini
Download Soal OSP Kimia 2019 – Soal OSP Kimia 2019 Nomor 1 PDF DOC
Sebanyak 1.200 kg pupuk urea, CO(NH2)2, disebar secara merata pada 10 hektar (1 hektar = 10.000 m2), maka jumlah (dalam gram) nitrogen yang ditambahkan untuk setiap m2 adalah
A. 2,8 g
B. 5,6 g
C. 8,4 g
D. 11,2 g
E. 14,0 g
Pembahasan Soal OSP Kimia 2019 Nomor 1 | Download Soal OSP Kimia 2019
Ar N = 14
Mr CO(NH2)2 = 60
m CO(NH2)2 = 1.200 kg
10 hektar = 100.000 m2
Perhitungan m N dalam CO(NH2)2
m N = (2.Ar N/Mr CO(NH2)2) x m CO(NH2)2
m N = (2.14/60) × 1.200 kg
m N = 560 kg
m N = 560.000 g
m N setiap m2 = 560.000 g/100.000 m2
m N setiap m2 = 5,6 g/m2
Kunci Jawaban Soal OSP Kimia 2019 Nomor 1: B
Download Soal OSP Kimia 2019 – Soal OSP Kimia 2019 Nomor 2 PDF DOC
Jika 1 liter etil alkohol pada 200C mengandung 1,04 x 1025 molekul, maka jumlah molekul selain etil alkohol dalam 1 liter sampel etil alkohol yang kemurniannya 99,99% adalah
A. 2,72 x 1020
B. 1,04 x 1021
C. 3,15 x 1022
D. 3,13 x 1023
E. 2,14 x 1024
Pembahasan Soal OSP Kimia 2019 Nomor 2 | Download Soal OSP Kimia 2019
% molekul selain etil alkohol
⇒ 100% – 99,99%
⇒ 0,01%
Jumlah molekul selain etil alkohol
⇒ 0,01% × 1,04 × 1025
⇒ 1,04 × 1021
Kunci Jawaban Soal OSP Kimia 2019 Nomor 2: B
Download Soal OSP Kimia 2019 – Soal OSP Kimia 2019 Nomor 3 PDF DOC
Cuplikan suatu senyawa diketahui mempunyai rumus empiris XBr2. Sebanyak 0.5000 gram cuplikan tersebut dilarutkan ke dalam air. Ke dalam larutan tersebut lalu ditambahkan larutan perak nitrat berlebih. Setelah dikeringkan, endapan AgBr yang diperoleh mempunyai massa 1,0198 gram. Massa atom relatif unsur X adalah
A. 208,51
B. 137,33
C. 67,72
D. 47,88
E. 24,25
Pembahasan Soal OSP Kimia 2019 Nomor 3 | Download Soal OSP Kimia 2019
m cuplikan = 0,5 g
Ar Br = 79,90
Ar Ag = 107,90
m AgBr = 1,0198 g
M AgBr = 187,80 g/mol
m Br dalam AgBr
⇒ 1,0198 g AgBr × [(79,90 g Br)/(187,80 g AgBr)]
⇒ 0,43388 g Br
m X = m cuplikan – m Br
m X = 0,5 g – 0,43388 g
m X = 0,06612 g
n AgBr = 1,0198 g / 187,80 g/mol
n AgBr = 0,00543 mol
XBr2 + 2AgNO3 → 2AgBr + X(NO3)2
n XBr2 = ½ n AgBr
n XBr2 = ½ 0,00543 mol
n XBr2 = 0,002715 mol
n X = n XBr2
n X = 0,002715 mol
M X = m X / n X
M X = (0,06612 g)/( 0,002715 mol)
M X = 24,35 g/mol
Jadi Ar X = 24,35
Kunci Jawaban Soal OSP Kimia 2019 Nomor 3: E
Download Soal OSP Kimia 2019 – Soal OSP Kimia 2019 Nomor 4 PDF DOC
Rumus kimia suatu garam ialah XCl2. Ion X dalam garam ini mempunyai 28 elektron. Logam X adalah
A. Ni
B. Co
C. Fe
D. Cu
E. Zn
Pembahasan Soal OSP Kimia 2019 Nomor 4 | Download Soal OSP Kimia 2019
XCl2 → X2+ + 2Cl–
Jumlah elektron X2+ = 28 elektron
Jumlah elektron X (netral)
⇒ 28 + muatan positif
⇒ (28 + 2) elektron
⇒ 30 elektron
Nomor atom X = jumlah elektron X
Nomor atom X = 30
Pada tabel periodik yang tersedia X dengan nomor atom 30 ialah Zn.
Kunci Jawaban Soal OSP Kimia 2019 Nomor 4: E
Download Soal OSP Kimia 2019 – Soal OSP Kimia 2019 Nomor 5 PDF DOC
Pada suhu kamar dan tekanan atmosfer, 1 gram oksigen mengisi ruang dengan volume O,764 liter, sedangkan 1 gram oksida nitrogen dalam kondisi yang sama mengisi ruang dengan volume 0,266 liter. Berdasarkan data tersebut, maka rumus oksida nitrogen termaksud adalah
A. NO2
B. NO3
C. NO5
D. N2O4
E. N2O5
Pembahasan Soal OSP Kimia 2019 Nomor 5 | Download Soal OSP Kimia 2019
Mr NO2 = 14 + 32 = 46
Mr NO3 = 14 + 48 = 62
Mr NO5 = 14 + 80 = 94
Mr N2O3 = 28 + 48= 76
Mr N2O5 = 28 + 80 = 108
Pada keadaan yang sama setiap 1 mol gas akan mempunyai volume yang sama pula (Hukum Gay Lussac). urip.info
1 g O2 = 1/32 mol
1/32 mol O2 0,764 L
Volume 1 mol gas O2
⇒ 32 × 0,764
⇒ 24,448 L/mol
Jika masa oksida nitrogen mempunyai volume 0,266 L
⇒ (0,266 L)/(24,448 L/mol)
⇒ 0,01088 mol
1 g NxOy = 0,01088 mol
Massa molar NxOy = (1 g)/( 0,01088 mol)
Massa molar NxOy = 91,911 g/mol
Massa molar NxOy = 92 g/mol
Pada alternatif balasan memang tidak tampak pribadi ada yang mempunyai Mr 92, tetapi Mr 92 ini mempunyai rumus N2O4 yang merupakan dimer dari NO2
Kunci Jawaban Soal OSP Kimia 2019 Nomor 5: A
Klik halaman 2 untuk nomor 6 – 10
Pembahasan Soal Pilihan Ganda OSP Kimia 2019 PDF DOC
Download Soal OSP Kimia 2019 – Soal OSP Kimia 2019 Nomor 6 PDF DOC
Pada 400 K dan tekanan 1 atm 40% dinitrogen tetraoksida, N2O4, terurai sesuai dengan persamaan reaksi:
N2O4(g) ⇌ 2 NO2(g)
Tekanan parsial NO2(g) adalah
A. 0,3956 atm
B. 0,4286 atm
C. 0,4615 atm
D. 0,5385 atm
E. 0,5714 atm
Pembahasan Soal OSP Kimia 2019 Nomor 6 | Download Soal OSP Kimia 2019
Dimisalkan jumlah N2O4 awal = 10 mol, bereaksi sebanyak 40% atau 4 mol
Kita M R S kan:
Reaksi: N2O4(g) ⇌ 2NO2(g)
Mula 10 mol
Reaksi -4 mol +8 mol
Setimbang 6 mol 8 mol
Fraksi mol NO2 (χ(NO2))
χ(NO2) = 8/(6+8)
χ(NO2) = 8/14
χ(NO2) = 0,5714
P(NO2) = χ(NO2) × P-total
P(NO2) = 0,5714 × 1 atm
P(NO2) = 0,5714 atm
Kunci Jawaban Soal OSP Kimia 2019 Nomor 6: E
Download Soal OSP Kimia 2019 – Soal OSP Kimia 2019 Nomor 7 PDF DOC
Orbital bibit unggul yang dipakai pada pembentukan ikatan XeF4, yang geometri senyawanya berbentuk bujur kandang adalah
A. sp2
B. sp
C. sp3d
D. d2sp3
E. sp3
Pembahasan Soal OSP Kimia 2019 Nomor 7 | Download Soal OSP Kimia 2019
54Xe → VIII-A →8 elektron valensi
Jumlah pasangan elektron ikatan 4(Xe–F) = 4 PEI
Jumlah elektron bebas = 8 – 4 = 4 elektron
Jumlah pasangan elektron bebas = (4 elektron)/2 = 2 PEB
Total pasangan elektron = 4 PEI + 2 PEB = 6 PE
Jumlah orbial hidrida harus 6 orbital untuk menampung 6 PE.
Dari alternatif balasan yang berjumlah 6 orbital hanya d2sp3, dengan rincian asal obital: 2 orbital d + 1 orbital s + 3 orbital p = 6 orbital.
Kunci Jawaban Soal OSP Kimia 2019 Nomor 7: D
Download Soal OSP Kimia 2019 – Soal OSP Kimia 2019 Nomor 8 PDF DOC
Di antara pasangan senyawa berikut yang mempunyai kemiripan geometri molekul adalah
A. CO2 dan OF2
B. CO2 dan BeCl2
C. SO2 dan CO2
D. PH3 dan BF3
E. H2O dan CO2
Pembahasan Soal OSP Kimia 2019 Nomor 8| Download Soal OSP Kimia 2019
CO2
→ atom sentra C
→ 4 elektron valensi C
→ 2 ikatan ganda pada C=O
→ 0 PEB
→ orbital bibit unggul sp
→ bentuk molekul linier
OF2
→ atom sentra O
→ 6 elektron valensi O
→ 2 ikatan tunggal pada O–F
→ 2 PEB
→ orbital bibit unggul sp3
→ bentuk molekul bengkok
BeCl2
→ atom sentra Be
→ 2 elektron valensi Be
→ 2 ikatan tunggal pada Be–Cl
→ 0 PEB
→ orbital bibit unggul sp
→ bentuk molekul linier
SO2
→ atom sentra S
→ 6 elektron valensi S
→ 2 ikatan ganda pada S=O
→ 1 PEB
→ orbital bibit unggul sp2
→ bentuk molekul bengkok
PH3
→ atom sentra P
→ 5 elektron valensi P
→ 3 ikatan tunggal pada P–H
→ 1 PEB
→ orbital bibit unggul sp3
→ bentuk molekul bengkok
BF3
→ atom sentra B
→ 3 elektron valensi B
→ 3 ikatan tunggal pada B–F
→ 0 PEB
→ orbital bibit unggul sp2
→ bentuk molekul segitiga datar
H2O
→ atom sentra O
→ 6 elektron valensi O
→ 2 ikatan tunggal pada O–H
→ 2 PEB
→ orbital bibit unggul sp3
→ bentuk molekul bengkok
A. CO2 (linier) dan OF2 (bengkok)
B. CO2 (linier) dan BeCl2 (linier)
C. SO2 (bengkok) dan CO2 (linier)
D. PH3 (bengkok) dan BF3 (segitiga datar)
E. H2O (bengkok) dan CO2 (linier)
Kunci Jawaban Soal OSP Kimia 2019 Nomor 8: B
Download Soal OSP Kimia 2019 – Soal OSP Kimia 2019 Nomor 9 PDF DOC
2CH2N2(s) + 3O2(g) → 2N2(g) + 2H2O(l) + 2CO(g) ; ΔH0 = -354,40 kkal
C(s) + O2(g) → CO2(g) ; ΔH0 = -93,97 kkal
2H2(g) + O2(g) → 2H2O(l) ; ΔH0 = -136,64 kkal
Nilai entalpi pembentukan standar CH2N2(s) (dalam kkal/mol) adalah
A. 123,79 kkal/mol
B. 14,91 kkal/mol
C. -14,91 kkal/mol
D. -29,82 kkal/mol
E. 29,82 kkal/mol
Pembahasan Soal OSP Kimia 2019 Nomor 9 | Download Soal OSP Kimia 2019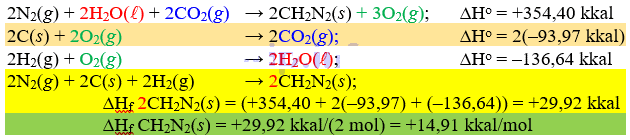
Kunci Jawaban Soal OSP Kimia 2019 Nomor 9: B
Download Soal OSP Kimia 2019 – Soal OSP Kimia 2019 Nomor 10 PDF DOC
Diketahui reaksi kesetimbangan berikut, masing-masing reaksi cenderung ke kanan:
N2H5+ + NH3 ⇌ NH4+ + N2H4
NH3 + HBr ⇌ NH4+ + Br–
N2H4 + HBr ⇌ N2H5+ + Br–
Berdasarkan isu tersebut, urutan kekuatan asam yang paling sempurna adalah
A. HBr > NH4+ > N2H5+
B. HBr > N2H5+ > NH4+
C. N2H5+ > N2H4 > NH4+
D. N2H5+ > HBr > NH4+
E. NH4+ > HBr > N2H4
Pembahasan Soal OSP Kimia 2019 Nomor 10 | Download Soal OSP Kimia 2019
Soal ini sanggup dipahami menurut konsep asam/basa Bronsted-Lowry. Asam ialah spesi yang sanggup mendonorkan proton, basa ialah spesi yang sanggup mendapatkan proton. Bila reaksi cenderung ke kanan maka asam di ruas kiri relatif lebih berpengaruh dibanding asam di ruas kanan.
Spesi yang bersifat asam:
Reaksi pertama: N2H5+ dan NH4+
→ kekuatan asam N2H5+ > NH4+
Reaksi kedua: HBr dan NH4+
→ kekuatan asam HBr > NH4+
Reaksi ketiga: HBr dan N2H5+
→ kekuatan asam HBr > N2H5+
Urutan kekuatan asam yang tepat:
HBr > N2H5+ > NH4+
Kunci Jawaban Soal OSP Kimia 2019 Nomor 10: B
Soal dan Pembahasan OSP Kimia 2019 Nomor 1-10 klik disini
Soal dan Pembahasan OSP Kimia 2019 Nomor 11-20 klik disini
Soal dan Pembahasan OSP Kimia 2019 Nomor 20-30 klik disini
Demikian tadi link d0wnl0ad soal dan pembahasan OSP Kimia tahun 2019 PDF DOC biar sanggup dijadikan acuan menghadapi OSN Kimia 2019 dan OSK OSP OSN 2020 2021 2022 dst.
Pembahasan Soal Pilihan Ganda OSP Kimia 2019 PDF DOC
Sumber aciknadzirah.blogspot.com

EmoticonEmoticon