Pembahasan Soal OSP Kimia 2016 PDF DOC – Dalam mempersiapkan OSP Kimia tahun 2017 2018 2019 2020 dan OSP tahun-tahun yang akan datang, maka perlu adanya pembahasan soal OSP Kimia tahun sebelumnya. Kali ini akan ada pembahasan soal Kimia Olimpiade Sains Nasional tingkat Provinsi tahun 2016. Pembahasan kali ini khusus Pilihan Ganda (Pilgan). Saya buat beberapa halaman, semoga membacanya tidak terlalu ke bawah.
Pembahasan Soal OSP Kimia Pilgan 2016 PDF DOC
Download PDF DOC | Soal OSP Kimia Nomor 1
Suatu oksida logam Pb mengandung persen massa 90,65% Pb. Rumus empiris oksida Pb tersebut adalah
A. Pb2O
B. PbO
C. Pb3O4
D. Pb2O3
E. PbO2
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 1
Jadi rumus empiris oksida Pb yakni Pb3O4
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 1 (C)
Download PDF DOC | Soal OSP Kimia Nomor 2
Dalam suatu wadah tertutup yang mengandung adonan 90,0 g gas CH4 dan 10,0 g gas argon (Ar), pada temperatur dan volume yang tetap, memiliki tekanan sebesar 250 torr. Tekanan parsial gas CH4 adalah
A. 143,0 torr
B. 100,0 torr
C. 10,7 torr
D. 239,0 torr
E. 26,6 torr
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 2
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 2
Download PDF DOC | Soal OSP Kimia Nomor 3
Berapa massa air (dalam g) yang terkandung di dalam 75,0 g larutan yang mengandung 6,10% K3PO4 adalah
A. 75,0 g
B. 73,2 g
C. 70,4 g
D. 68,1 g
E. 62,8 g
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 3
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 3
Download PDF DOC | Soal OSP Kimia Nomor 4
Perhatikan reaksi berikut :
H2SO3(aq) + Sn4+(aq) + H2O(l) → Sn2+(aq) + HSO4– (aq) + 3H+(aq)
Pernyataan yang benar yakni :
A. H2SO3 adalah reduktor lantaran cenderung direduksi
B. H2SO3 adalah reduktor lantaran cenderung di oksidasi
C. Sn4+ adalah oksidator lantaran cenderung di oksidasi
D. Sn4+ adalah reduktor lantaran cenderung di oksidasi
E. H2SO3 adalah reduktor dan oksidator
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 4
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 4
Download PDF DOC | Soal OSP Kimia Nomor 5
Spesi yang memiliki jumlah elektron yang sama dengan molekul air adalah
A. H2S
B. BH3
C. OH–
D. BeH2
E. Ne+2
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 5
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 5
Download PDF DOC | Soal OSP Kimia Nomor 6
Ion-ion berikut ini yakni isoelektrik. Di antara ion-ion berikut yang memiliki radius paling kecil adalah
A. Br–
B. Sr2+
C. Rb+
D. Se2–
E. Semua spesi tersebut memiliki radius yang sama lantaran memiliki jumlah elektron yang sama
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 6
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 6
Download PDF DOC | Soal OSP Kimia Nomor 7
Dari senyawa berikut: CH4, AsH3, CH3NH2, H2Te, HF, senyawa yang mengatakan adanya ikatan hidrogen adalah
A. AsH3, H2Te
B. AsH3, CH3NH2
C. CH4, AsH3, H2Te
D. CH3NH2, HF
E. HF, H2Te
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 7
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 7
Download PDF DOC | Soal OSP Kimia Nomor 8
Perhatikan pasangan cairan berikut ini
i. Benzena, C6H6 dan heksana, C6H14
ii. Air dan metanol, CH3OH
iii. Air dan heksana, C6H14
Pasangan yang sanggup saling melarutkan (miscible) adalah
A. Hanya pasangan (i)
B. Hanya pasangan (ii)
C. Hanya pasangan (i) dan (ii)
D. Pasangan (i), (ii), dan (iii)
E. Hanya pasangan (ii) dan (iii)
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 8
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 8
Download PDF DOC | Soal OSP Kimia Nomor 9
Struktur Lewis untuk molekul hidrogen sianida (HCN) menunjukan
A. 2 ikatan rangkap 2 dan 2 pasang elektron bebas pada atom N
B. 1 ikatan C–H, 1 ikatan C=N, 1 pasang elektron bebas pada atom C dan 1 pasang elektron bebas pada atom N
C. 1 ikatan C–H, 1 ikatan C–N, 2 pasang elektron bebas pada atom C dan 3 pasanga elektron pada atom N
D. 1 ikatan C≡N, 1 ikatan N–H dan 2 pasang elektron bebas pada atom C
E. 1 ikatan C≡N, 1 ikatan C–H dan 1 pasang elektron bebas pada atom N
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 9
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 9
Download PDF DOC | Soal OSP Kimia Nomor 10
Bentuk geometri pasangan elektron untuk molekul yang atom pusatnya masing-masing memiliki pasangan elektron berturut-turut sebanyak: 4 pasang, 3 pasang dan 2 pasang adalah
A. tetrahedral, trigonal planar, linier
B. tetrahedral, trigonal piramidal, linier
C. tetrahedral, trigonal planar, bengkok(bent)
D. piramidal, trigonal planar, linier
E. tidak ada tanggapan yang benar
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 10
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 10
Download PDF DOC | Soal OSP Kimia Nomor 11
Pernyataan yang benar mengenai metana (CH4) dan ion ammonium (NH4+) adalah
A. secara kimia, CH4dan NH4+ tidak sanggup dibedakan satu dengan lainnya
B. geometri CH4adalah tetrahedral, sedangkan NH4+ adalah bidang segiempat datar
C. keduanya memiliki sifat fisik yang sama
D. CH4dan NH4+ adalah isoelektrik
E. Pada temperatur kamar, CH4dan NH4+ adalah gas
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 11
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 11
Download PDF DOC | Soal OSP Kimia Nomor 12
Perubahan entalpi, ΔH untuk reaksi
4HBr(g) + O2(g) ⇌2H2O(g) + 2Br2(g)
Adalah -276 kJ untuk permol O2. Bila adonan reaksi berada dalam keadaan kesetimbangan, maka perlakuan yang akan menggeser reaksi ke arah kanan adalah
A. Penambahan katalis
B. Memindahkan adonan reaksi ke bawah yang volumenya lebih besar
C. Menurunkan tekanan luar
D. Mengeluarkan sebagian Br2(g)
E. Menaikan temperatur
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 12
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 12
√ Pembahasan Soal OSP Kimia 2016 PDF DOC
Download PDF DOC | Soal OSP Kimia Nomor 13
Suatu larutan memiliki konsentrasi ion hidrogen 0,001 M. Pernyataan berikut ini:
i. Larutan memiliki pH = 3
ii. Larutan bersifat asam
iii. Konsentrasi ion hidroksida yakni 1×10–11 (Diketahui: Kw = 1×10–14)
Mengenai ketiga pernyataan mengenai larutan tersebut, pernyataan yang benar adalah
A. Semua pernyatan benar
B. Hanya (i)
C. Hanya (i) dan (ii)
D. Hanya (iii)
E. Semua pernyataan salah
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 13
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 13
Download PDF DOC | Soal OSP Kimia Nomor 14
Dalam pelarut air, anion yang merupakan basa paling besar lengan berkuasa adalah
A. HSO4–
B. Cl–
C. C2H3O2– (ion asetat)
D. NO3–
E. Semua yakni basa konjugasi dari asam besar lengan berkuasa dan memiliki kekuatan basa yang sama
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 14
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 14
Download PDF DOC | Soal OSP Kimia Nomor 15
Dari rentang pH perubahan warna indikator berikut ini, maka indikator yang sanggup dipakai untuk titrasi larutan NH3(aq) dengan larutan HCl(aq) adalah:
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 15
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 15
Download PDF DOC | Soal OSP Kimia Nomor 16
Untuk menciptakan larutan bufer, yang sanggup di tambahkan ke dalam larutan asam asetat adalah
A. Hanya natrium asetat
B. Natrium asetat atau natrium hidroksida
C. Hanya asam nitrat
D. Asam hidrofluorat atau asam nitrat
E. Hanya natrium hidroksida
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 16
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 16
Download PDF DOC | Soal OSP Kimia Nomor 17
Warna hijau pada flora disebabkan oleh pigmen klorofil yang terdapat di dalam kloroplas. Pigmen ini berfungsi sebagai penangkap cahaya matahari dalam proses fotosintesis. Reaksi fotosintesis meruakan reaksi orde ke-nol. Perbandingan laju berkurangnya molekul air, H2O dan laju pembentukan glukosa (C6H12O6) dalam reaksi tersebut adalah
A. 1 : 2
B. 2 : 1
C. 6 : 1
D. 1 : 6
E. 1 : 1
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 17
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 17
Download PDF DOC | Soal OSP Kimia Nomor 18
Berikut ini yakni profil energi reaksi A → B
Nilai yang akan berubah bila ditambahkan katalis adalah
A. Hanya I
B. Hanya II
C. Hanya III
D. Hanya II dan III
E. I, II, dan III
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 18
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 18
Download PDF DOC | Soal OSP Kimia Nomor 19
Reaksi berikut ini
2HgCl2 + C2O42– → 2Cl– + 2CO2 + Hg2Cl2
Untuk memilih laju awal reaksi, reaksi dilakukan dengan memakai variasi konsentrasi dua pereaksi. Hasilnya diperoleh ibarat pada data tabel berikut ini
Persamaan laju awal reaksi tersebut adalah
A. Laju = r = k[HgCl2] [C2O42–]
B. Laju = r = k[HgCl2] 2 [C2O42–]2
C. Laju = r = k[HgCl2] [C2O42–]2
D. Laju = r = k[HgCl2]2 [C2O42–]
E. Laju = r = k[HgCl2] [C2O42–]4
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 19
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 19
Download PDF DOC | Soal OSP Kimia Nomor 20
Perhatikan diagram sel elektrokimia berikut
Bila anda mengamati reaksi di dalam sel tersebut berlangsung, ternyata elektroda timah putih (Sn) nampak semakin kecil sedangkan elektroda perak (Ag) terbentuk endapan (deposit). Pernyataan yang benar yakni :
A. Elektroda perak yakni katoda dan elektroda timah putih yakni anoda
B. Elekron mengalir dari elektroda perak ke elektroda timah putih
C. Ion nitrat mengalir melalui jembatan garam ke larutan perak nitrat
D. Setengah reaksi yang terjadi di elektroda timah putih yakni Sn4+ + 2e → Sn2+
E. Elektroda perak yakni anoda dan elektroda timah putih yakni katoda
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 20
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 20
Download PDF DOC | Soal OSP Kimia Nomor 21
Perhatikan sel volta dengan notasi berikut ini:
Pb|Pb(NO3)2(1,0 M) || AgNO3(1,0 M)|Ag
Bila sel tersebut bekerja, massa lempeng Ag semakin berat dan konsentrasi ion Ag+ dalam larutan disekeliling lempeng Ag semakin menurun, sedangkan lempengan Pb massanya semakin berkurang dan konsentrasi ion Pb2+ dalam larutan disekeliling lempeng Pb naik. Dari pernyataan berikut, reaksi setengah sel yang paling sempurna untuk menyatakan reaksi pada elektroda negatif dari sel tersebut di atas yakni :
A. Pb2+ + 2e → Pb
B. Pb → Pb2+ + 2e
C. Ag+ + e → Ag
D. Ag → Ag+ + e
E. Jawaban A, B, C dan D semua salah
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 21
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 21
Download PDF DOC | Soal OSP Kimia Nomor 22
Reaksi reaksi berikut ini, manakah yang entropi sistemnya meningkat:
A. Ag+(aq) + Cl–(aq) → AgCl(s)
B. C(s) + O2(g) → 2CO(g)
C. H2(g) + Cl2(g) → 2HCl(g)
D. N2(g) + 2H2(g) → 2NH3(g)
E. H2O(l) → H2O(s)
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 22
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 22
Download PDF DOC | Soal OSP Kimia Nomor 23
Berikut ini diberikan tabel data termodinamika :
Berdasarkan data tersebut di atas, penguapan PCl3(l) adalah:
A. Tidak impulsif pada temperatur rendah, dan impulsif pada temperatur tinggi
B. Spontan pada temperatur rendah dan non-spontan pada temperatur tinggi
C. Spontan pada semua temperatur
D. Non-spontan pada semua temperatur
E. Tidak cukup warta untuk menarik kesimpulan
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 23
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 23
Download PDF DOC | Soal OSP Kimia Nomor 24
Nama dari senyawa yang diilustrasikan berikut ini
adalah
A. diasetamida
B. formil asetmida
C. dimetilasetat
D. N,N-dimetilformamida
E. dimetilamina
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 24
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 24
Download PDF DOC | Soal OSP Kimia Nomor 25
Hubungan antara kedua struktur berikut ini adalah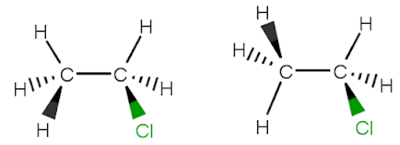
A. Isomer struktur
B. Isomer geometri
C. Isomer konformasi
D. Isomer identik
E. Isomer optik
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 25
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 25
Download PDF DOC | Soal OSP Kimia Nomor 26
Alkohol yang bila dioksidasi akan menghasilkan keton adalah:
A. 1-propanol
B. Metanol
C. 2-metil-2-propanol
D. 2-propanol
E. Semuanya membentuk keton bila dioksidasi
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 26
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 26
Download PDF DOC | Soal OSP Kimia Nomor 27
Pereaksi yang jikalau bereaksi dengan etuna akan menghasilkan CH2Br-CHBrCl adalah
A. HCl, kemudian HBr
B. HCl, kemudian Br2
C. Cl2, kemudian HBr
D. Cl2, kemudian Br2
E. H2, kemudian Br2
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 27
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 27
Download PDF DOC | Soal OSP Kimia Nomor 28
Produk utama yang dihasilkan dari reaksi adisi antara satu equivalen HCl dengan 1-fenil-1,3-butadiena sesuai dengan denah reaksi berikut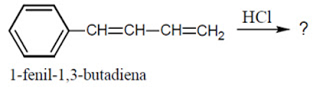
adalah
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 28
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 28
Download PDF DOC | Soal OSP Kimia Nomor 29
Jika senyawa 1-naftol dinitrasi dengan reagan [HNO3, H2SO4] ibarat pada persamaan reaksi berikut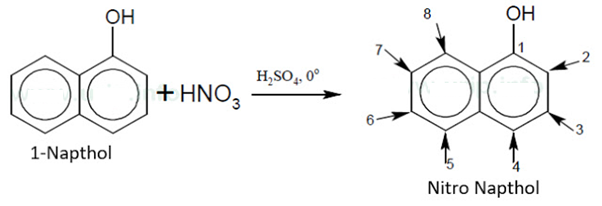
Maka gugus nitro (–NO2) akan menempati posisi :
A. 3 dan 6
B. 3 dan 4
C. 6 dan 8
D. 7 dan 5
E. 2 dan 4
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 29
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 29
Download PDF DOC | Soal OSP Kimia Nomor 30
Sifat kebasan turunan ammonia dipengaruhi oleh adanya subtituen dan struktur molekulnya,maka urutan kebasaan mulai dari yang paling basa hingga yang kurang basa dari senyawa berikut di bawah ini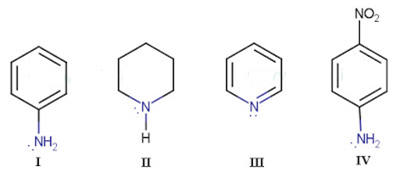
adalah
A. II > III > I > IV
B. II > IV > III > I
C. I > II > III > IV
D. I > III > IV > II
E. IV > II > I > III
Download PDF DOC | Pembahasan Soal OSP Kimia Nomor 30
Download PDF DOC | Kunci Jawaban Soal OSP Kimia Nomor 30
Demikian tadi pembahasan secara lengkap dari Soal OSP Kimia tahun 2016. Pembahasan ini dilakukan oleh Pak Urip.Info guru super keren. Apabila ada yang ingin di kritisi, silahkan kontak admin atau komentar di kolom di bawah ini. Semoga sukses untuk seleksi OSN tingkat Provinsi.
√ Pembahasan Soal OSP Kimia 2016 PDF DOC
Sumber aciknadzirah.blogspot.com
EmoticonEmoticon