Download Pembahasan Soal SBMPTN 2018 Kimia Nomer 32 Semua Kode Soal | Bentuk Molekul dan Kepolaran – Pelaksanaan SBMPTN 2019 sebentar lagi akan digelar. Berbagai persiapan dari murid-murid yang mengharapkan kampus negeri mulai dilakukan. Salah satunya yaitu mencari soal dan pembahasan soal kimia SBMPTN 2018. Dalam beberapa goresan pena ke depan kita fokus bahas soal SBMPTN Kimia 2018. Alhamdulillah pak urip.info sudah rilis pembahasan soal SBMPTN jadi bias menambah wawasan kita dalam persiapan masuk Perguruan Tinggi Negeri tahun 2019.
Download Pembahasan Soal SBMPTN 2018 Kimia Nomer 32 Semua Kode Soal | Bentuk Molekul dan Kepolaran

Dalam goresan pena kali ini, khusus untuk Soal SBMPTN Kimia Nomor 32 dengan pokok bahasan bentuk molekul dan kepolaran. Nomor sama berarti pokok bahasan sama namun bentuk soal berbeda.
Jumlah paket soal yang terkumpul sebanyak 23 arahan berbeda. Namun, jikalau sahabat mempunyai paket soal lain, silakan disampaikan untuk dibahas lebih lanjut. Jadi, tulisan-tulisan ini fokus satu topik bahasan.
Soal SBMPTN Kimia Nomor 32 – Kode 402, Kode 420, Kode 422, Kode 463, Kode 472
Nomor atom S dan F masing-masing yaitu 16 dan 9. Kedua unsur tersebut sanggup membentuk molekul SF4. Bentuk molekul dan kepolaran senyawa SF4 adalah ….
(A) tetrahedral dan nonpolar
(B) bipiramida segitiga dan polar
(C) planar segiempat dan nonpolar
(D) jungkat-jungkit dan polar
(E) piramida segiempat dan nonpolar
Pembahasan Soal SBMPTN Kimia Nomor 32 – Kode 402, Kode 420, Kode 422, Kode 463, Kode 472
Konfigurasi elektron unsur S 1s2 2s2 2p6 3s2 3p4
atau
Konfigurasi elektron Bohr (perkulit) unsur S = 2-8-6
Elektron valensi unsur S = 6
Konfigurasi elektron unsur F 1s2 2s2 2p5
atau
Konfigurasi elektron Bohr unsur F = 2-7.
Elektron valensi unsur F = 7
SF4 jumlah elektron valensi = ELEKTRON VALENSI S + (ELEKTRON VALENSI F × banyaknya F)
= 6 + (7×4)
= 6 + 28
= 34
Jumlah PEI = jumlah elektron valensi : 8
Jumlah PEI = 34/8
Jumlah PEI = 4 dan sisa 2 elektron valensi
Angka penyebut 8 dipakai dengan asumsi semua atom memenuhi hukum oktet.
Jumlah PEB = sisa elektron valensi : 2
Jumlah PEB = 2/2
Jumlah PEB = 1 PEB
SF4 → 4 PEI (X4) dan 1 PEB (E)
Jadi tipe molekul SF4 adalah AX4E dengan bentuk jungkat-jungkit.
Karena terdapat 1 PEB menyebabkan tarikan elektron menjadi tidak merata atau asimetris maka SF4 bersifat polar.

Jawaban pilihan ganda: D.
Soal SBMPTN Kimia Nomor 32 – Kode 403, Kode 429

Senyawa di atas yang bersifat polar adalah….
(A) 1, 2, 3, dan 4
(B) 1, 2, dan 3
(C) 1 dan 3
(D) 2 dan 4
(E) hanya 4
Pembahasan Soal SBMPTN Kimia Nomor 32 Kode 403, Kode 429
Mohon diperhatikan bahwa senyawa polar mempunyai ciri khusus berupa mempunyai pasangan elektron bebas atau PEB pada atom sentra dan strukturnya tidak simetris. Dari keempat struktur molekul yang mempunyai PEB hanya NCl3 (molekul nomor 4).
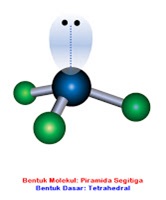
Jawaban pilihan ganda: D.
Soal SBMPTN Kimia Nomor 32 Kode 418, Kode 450, Kode 457, Kode 471
Unsur F (nomor atom = 9) dan M (nomor atom = 54) membentuk molekul MF4. Bentuk molekul dan sifat kepolaran molekul MF4 adalah ….
(A) tetrahedral dan nopolar
(B) planar segiempat dan nonpolar
(C) primida dan polar
(D) jungkat-jungkit dan polar
(E) bipiramida segitiga dan polar
Pembahasan Soal SBMPTN Kimia Nomor 32 Kode 418, Kode 457, Kode 471
Konfigurasi elektron unsur F: 1s2 2s2 2p5
atau
Konfigurasi elektron unsur Bohr = 2-7
Elektron valensi unsur F = 7
Konfigurasi elektron unsur M: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6.
atau
Konfigurasi elektron unsur Bohr = 2-8-18-18-8
Elektron valensi unsur M = 8
MF4 jumlah elektron valensi = elektron valensi M + (elektron valensi F × banyaknya F)
= 8 + (7×4)
= 8 + 28
= 36
Jumlah PEI = jumlah elektron valensi : 8
Jumlah PEI = 36/8
Jumlah PEI = 4 dan sisa 4 elektron valensi
Angka penyebut 8 dipakai dengan asumsi semua atom memenuhi hukum oktet.
Jumlah PEB = sisa elektron valensi : 2
Jumlah PEB = 4/2
Jumlah PEB = 2 PEB
MF4 → 4 PEI (X4) dan 2 PEB (E2)
Jadi tipe struktur MF4 adalah AX4E2 dengan bentuk bujur kandang atau planar segiempat dan bersifat nonpolar alasannya yaitu posisi PEB berada pada posisi yang saling meniadakan kekuatan tarikan elektron.

Jawaban pilihan ganda: B.
Lanjut ke halaman selanjutnya
Pembahasan Soal SBMPTN 2018 Kimia Nomer 32 Semua Kode Soal | Bentuk Molekul dan Kepolaran
Soal SBMPTN Kimia Nomor 32 Kode 412, Kode 428
Molekul yang mempunyai momen dipol (μ) lebih besar dari nol bersifat polar. Senyawa di bawah ini yang bersifat polar yaitu ….
(A) CO2
(B) OCS
(C) CCl4
(D) CH4
(E) BF3
Pembahasan Soal SBMPTN Kimia Nomor 32 Kode 412, Kode 428
Bila mengikuti alur memilih kepolaran suatu molekul ibarat pada goresan pena ini, maka jawabannya eksklusif tertuju ke pilihan (B) yang benar.
Pertama harus ditentukan atom sentra dari molekul. Atom sentra biasanya mempunyai keelektronegatifan lebih kecil dibanding atom lain dalam molekul itu. Biasa terletak di sebelah bawah atau sebelah kiri bila dilihat dalam tabel periodik unsur.
CO2, OCS, CCl4, CH4, keempat molekul ini atom pusatnya yaitu C, selain C beerperan sebagai atom luar (atom yang diikat oleh atom pusat). Pada BF3 atom pusatnya yaitu B, atom luarnya yaitu F.
Bila atom-atom luar suatu molekul berbeda biasanya akan bersifat polar. Dari kelima molekul hanya OCS yang atom luarnya berbeda, atom luarnya yaitu O dan S. Keelektronegatifan O > S. Bila atom luar berbeda biasanya keelektronegatifannya akan berbeda.

Keelektronegatifan berbeda akan menyebabkan tarikan (sebaran/distribusi) elektron tidak merata atau terkumpul pada atom luar yang lebih elektronegatif. Istilah sebaran elektron yang ibarat itu disebut polar (terkutub, terkumpul pada satu titik).
Jawaban pilihan ganda: B.
Soal SBMPTN Kimia Nomor 32 Kode 419, Kode 453, Kode 459:
Nomor atom O, F, dan Xe masing-masing yaitu 8, 9, dan 54. Bentuk dan kepolaran molekul XeOF4 adalah….
(A) piramida segitiga dan nonpolar
(B) piramida segiempat dan polar
(C) tetrahedral dan nonpolar
(D) piramida dan polar
(E) planar segiempat dan nonpolar
Pembahasan Soal SBMPTN Kimia Nomor 32 Kode 419, Kode 453, Kode 459:
Bila mengikuti alur memilih kepolaran suatu molekul ibarat pada goresan pena ini, maka sanggup eksklusif disimpulkan sifat molekul tersebut yaitu polar.
XeOF4 Xe sebagai atom pusat, O dan F sebagai atom luar. Karena atom luar ada yang berbeda dan jumlahnya tidak sama maka sudah dipastikan XeOF4 bersifat polar. Tinggal memilih bentuk molekul yang benar, B atau D.
Konfigurasi elektron O: 1s2 2s2 2p4
atau
Konfigurasi elektron Bohr = 2-6
Elektron valensi O = 6
Konfigurasi elektron F: 1s2 2s2 2p5
atau
Konfigurasi elektron Bohr = 2-7
Elektron valensi F = 7
Konfigurasi elektron Xe: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6.
atau
Konfigurasi elektron Bohr = 2-8-18-18-8
Elektron valensi Xe = 8
XeOF4 jumlah elektron valensi = elektron valensi Xe + (elektron valensi O × banyaknya O) + (elektron valensi F × banyaknya F)
XeOF4 jumlah elektron valensi = 8 + 6 + (7×4)
XeOF4 jumlah elektron valensi = 8 + 6 + 28
XeOF4 jumlah elektron valensi = 42
Jumlah PEI = jumlah elektron valensi : 8
Jumlah PEI = 42/8
Jumlah PEI = 5 dan sisa 2 elektron valensi
Angka penyebut 8 dipakai dengan asumsi semua atom memenuhi hukum oktet.
Jumlah PEB = sisa elektron valensi : 2
Jumlah PEB = 2/2
Jumlah PEB = 1 PEB
XeOF4 → 5 PEI (X5) dan 1 PEB (E)

Jadi tipe struktur XeOF4 adalah AX5E ini sama dengan bentuk oktahedral yang terpancung 1 sudut disebut piramida segiempat.
Bentuk molekul XeOF4 piramida segiempat dan bersifat polar alasannya yaitu mempunyai 1 PEB.
Jawaban pilihan ganda: B.
Soal SBMPTN Kimia Nomor 32 Kode 421, Kode 460:
Molekul SO3 (nomor atom S dan O masing-masing yaitu 16, dan 8 mempunyai bentuk dan kepolaran molekul….
(A) tetrahedral dan nonpolar
(B) piramida segitiga dan polar
(C) planar segitiga dan nonpolar
(D) bentuk V dan polar
(E) jungkat-jungkit dan polar
Pembahasan Soal SBMPTN Kimia Nomor 32 Kode 421, Kode 460
SO3, S sebagai atom pusat, O sebagai atom luar.
Konfigurasi elektron unsur S: 1s2 2s2 2p6 3s2 3p4
atau
Konfigurasi elektron Bohr = 2-8-6
Elektron valensi unsur S = 6
Konfigurasi elektron unsur O: 1s2 2s2 2p4
atau
Konfigurasi elektron Bohr = 2-6
Elektron valensi unsur O = 6
SO3 jumlah elektron valensi = elektron valensi S + (elektron valensi O × banyaknya O)
SO3 jumlah elektron valensi = 6 + (6×3)
SO3 jumlah elektron valensi = 6 + 18
SO3 jumlah elektron valensi = 24
Jumlah PEI = jumlah elektron valensi : 8
Jumlah PEI = 24/8
Jumlah PEI = 3 dan tanpa sisa elektron valensi
Angka penyebut 8 dipakai dengan asumsi semua atom memenuhi hukum oktet.
Jumlah PEB = 0, alasannya yaitu jumlah elektron valensi tidak ada sisa hasil bagi dari 8
SO3 → 3 PEI (X3) dan 0 PEB
Jadi tipe struktur SO3 adalah AX3 maka bentul molekul SO3 segitiga datar atau planar segitiga. Karena semua atom luar sama (ada 3 O) dan tanpa mempunyai PEB maka SO3 bersifat nonpolar.

Jawaban pilihan ganda: C.
Soal SBMPTN Kimia Nomor 32 Kode 423, Kode 452:
Nomor atom B, F, dan Cl berturut-turut yaitu 5, 9, dan 17.
Bentuk dan sifat kepolaran molekul BF2Cl adalah….
(A) bipiramida segitiga dan polar
(B) bentuk T dan polar
(C) planar segitiga dan polar
(D) jungkat-jungkit dan nonpolar
(E) tetrahedral dan nonpolar
Pembahasan Soal SBMPTN Kimia Nomor 32 Kode 423, Kode 452:
Bila mengikuti alur memilih kepolaran suatu molekul ibarat pada goresan pena ini, maka sanggup eksklusif disimpulkan sifat molekul tersebut yaitu polar.
BF2Cl, B sebagai atom pusat, F dan Cl sebagai atom luar. Karena atom luar ada yang berbeda dan jumlahnya tidak sama maka sudah dipastikan BF2Cl bersifat polar. Jawaban yang sudah niscaya salah yaitu D (karena sifatnya nonpolar)
Konfigurasi elektron unsur B: 1s2 2s2 2p1
atau
Konfigurasi elektron Bohr = 2-3
Elektron valensi unsur B = 3
Konfigurasi elektron unsur F: 1s2 2s2 2p5
atau
Konfigurasi elektron Bohr = 2-7
Elektron valensi unsur F = 7
Konfigurasi elektron unsur Cl: 1s2 2s2 2p6 2s2 2p5
atau
Konfigurasi elektron Bohr = 2-8-7
Elektron valensi unsur Cl = 7
BF2Cl jumlah elektron valensi = elektron valensi B + (elektron valensi F × banyaknya F) + (elektron valensi Cl × banyaknya Cl)
BF2Cl jumlah elektron valensi = 3 + (7×2) + 7
BF2Cl jumlah elektron valensi = 3 + 14 + 7
BF2Cl jumlah elektron valensi = 24
Jumlah PEI = jumlah elektron valensi : 8
Jumlah PEI = 24/8
Jumlah PEI = 3 dan tanpa sisa elektron valensi
Angka penyebut 8 dipakai dengan asumsi semua atom memenuhi hukum oktet.
Jumlah PEB = 0 (karena tanpa sisa elektron valensi setelag dibagi 8)
BF2Cl → 3 PEI (X3) dan 0 PEB
Jadi tipe struktur BF2Cl adalah AX3, bentuk BF2Cl segitiga datar, atau planar segitiga namun bersifat polar alasannya yaitu adanya atom luar yang berbeda (beda keelektronegatifannya) sehingga tarikan elektron dari 3 ikatan menjadi tidak sama atau terkutub.
Jawaban pilihan ganda: C.
Soal SBMPTN Kimia Nomor 32 Kode 441, Kode 461:
Atom S (nomor atom 16) merupakan atom sentra dalam senyawa dengan O (nomor atom 8). Kedua spesies berikut yang bersifat nonpolar dan tidak mempunyai pasangan elektron bebas pada atom S yaitu ….
(A) SO dan SO32–
(B) SO2 dan SO32–
(C) SO3 dan SO32–
(D) SO2 dan SO42–
(E) SO3 dan SO42–
Pembahasan Soal SBMPTN Kimia Nomor 32 Kode 421, Kode
Untuk menjawab soal ini setidaknya perlu menganalisis semua spesies biar sanggup kita ketahui yang bersifat nonpolar dan keduanya tanpa PEB.
S sebagai atom pusat, O sebagai atom luar.
Konfigurasi elektron unsur S: 1s2 2s2 2p6 3s2 3p4
atau
Konfigurasi elektron unsur Bohr = 2-8-6
Elektron valensi S = 6
Konfigurasi elektron unsur O: 1s2 2s2 2p4
atau
Konfigurasi elektron unsur Bohr = 2-6
Elektron valensi unsur O = 6
SO
SO jumlah elektron valensi = elektron valensi S + (elektron valensi O × banyaknya O)
SO jumlah elektron valensi = 6 + (6×1)
SO jumlah elektron valensi = 6 + 6
SO jumlah elektron valensi = 12
Jumlah PEI = jumlah elektron valensi : 8
Jumlah PEI = 12/8
Jumlah PEI = 1 dan sisa 4 elektron valensi
Jumlah PEB = sisa elektron valensi : 2
SO jumlah elektron valensi = 4/2
Jumlah PEB = 2 PEB
SO → 1 PEI (X) dan 2 PEB (E2)
Jadi tipe struktur SO adalah AXE2 maka bentul molekul SO linier bersifat polar dan mememiliki 2 PEB.
SO2
SO2 jumlah elektron valensi = elektron valensi S + (elektron valensi O × banyaknya O)
SO2 jumlah elektron valensi = 6 + (6×2)
SO2 jumlah elektron valensi = 6 + 12
SO2 jumlah elektron valensi = 18
Jumlah PEI = jumlah elektron valensi : 8
Jumlah PEI = 18/8
Jumlah PEI = 2 dan sisa 2 elektron valensi
Jumlah PEB = sisa elektron valensi : 2
Jumlah PEB = 2/2
Jumlah PEB = 1 PEB
SO2 → 2 PEI (X2) dan 1 PEB (E)
Jadi tipe struktur SO2 adalah AX2E maka bentul molekul SO2 bentuk V (bengkok) bersifat polar dan mememiliki 1 PEB.
SO3
SO3 jumlah elektron valensi = elektron valensi S + (elektron valensi O × banyaknya O)
SO3 jumlah elektron valensi = 6 + (6×3)
SO3 jumlah elektron valensi = 6 + 18
SO3 jumlah elektron valensi = 24
Jumlah PEI = jumlah elektron valensi : 8
Jumlah PEI = 24/8
Jumlah PEI = 3 dan tanpa sisa elektron valensi
Jumlah PEB = 0, alasannya yaitu jumlah elektron valensi tidak ada sisa hasil bagi dari 8
SO3 → 3 PEI (X3) dan 0 PEB
Jadi tipe struktur SO3 adalah AX3 maka bentul molekul SO3 segitiga datar atau planar segitiga. Karena semua atom luar sama (ada 3 O) dan tanpa mempunyai PEB maka SO3 bersifat nonpolar.
SO32–
SO32– jumlah elektron valensi = elektron valensi S + (elektron valensi O × banyaknya O) + muatan negatif
SO32– jumlah elektron valensi = 6 + (6×3) + 2
SO32– jumlah elektron valensi = 6 + 18 + 2
SO32– jumlah elektron valensi = 26
Jumlah PEI = jumlah elektron valensi : 8
Jumlah PEI = 26/8
Jumlah PEI = 3 dan sisa 2 elektron valensi
Jumlah PEB = sisa elektron valensi : 2
Jumlah PEB = 2/2
Jumlah PEB = 1 PEB
SO32– → 3 PEI (X3) dan 1 PEB (E)
Jadi tipe struktur SO32– adalah AX3E maka bentul molekul SO32– bentuk piramida segitiga bersifat polar dan mempunyai 1 PEB.
SO42–
SO42– jumlah elektron valensi = elektron valensi S + (elektron valensi O × banyaknya O) + muatan negatif
SO42– jumlah elektron valensi = 6 + (6×4) + 2
SO42– jumlah elektron valensi = 6 + 24 + 2
SO42– jumlah elektron valensi = 32
Jumlah PEI = jumlah elektron valensi : 8
Jumlah PEI = 32/8
Jumlah PEI = 4 dan tanpa sisa elektron valensi
Jumlah PEB = 0, alasannya yaitu jumlah elektron valensi tidak ada sisa hasil bagi dari 8
SO42– → 4 PEI (X6) dan 0 PEB
Jadi tipe struktur SO42– adalah AX4 maka bentul molekul SO42– bentuk tetra hedral bersifat nonpolar dan tanpa mempunyai PEB.
Jawaban pilihan ganda: E.
Soal SBMPTN Kimia Nomor 32 Kode 444:
Suatu senyawa yang terbentuk antara satu atom P (nomor atom 15) dan tiga atom Br (nomor atom 35) mempunyai struktur Lewis sebagai berikut.

Bentuk dan kepolaran molekul tersebut yaitu ….
(A) planar segitiga dan nonpolar
(B) bentuk T dan polar
(C) tetrahedral dan nonpolar
(D) piramida segitiga dan polar
(E) planar segitiga dan polar
Pembahasan Soal SBMPTN Kimia Nomor 32 Kode 444
Di soal sudal diketahui struktur Lewis, maka sudah bias ditentukan tipe sturkturnya.
PBr3 → 3 PEI (X3) dan 1 PEB (E)
PBr3 → AX3E → piramida segitiga, alasannya yaitu mempunyai 1 PEB dan bentuk molekul tidak simetri maka PBr3 bersifat polar.
Jawaban pilihan ganda: D.
Demikian tadi pembahasan soal nomer 32 dari banyak sekali paket soal SBMPTN mapel Kimia tahun 2018 untuk persiapan latihan SBMPTN 2019. Semoga dengan hadirnya pembahasan soal yang digagas oleh guru hebat, Pak URIP.INFO, sanggup memperlihatkan fasilitas dalam persiapan.
Untuk soal-soal nomer lain, silahkan klik link di bawah ini ya. JANGAN LUPA UNTUK SHARE biar teman-teman lain mengetahui adanya latihan soal SBMPTN Kimia 2019.
Download Soal dan Pembahasan Kimia SBMPTN 2018 Nomer 32 PDF
Download Soal dan Pembahasan Kimia SBMPTN 2018 Nomer 33 PDF
Download Soal dan Pembahasan Kimia SBMPTN 2018 Nomer 34 PDF
Download Soal dan Pembahasan Kimia SBMPTN 2018 Nomer 35 PDF
Download Soal dan Pembahasan Kimia SBMPTN 2018 Nomer 36 PDF
Download Soal dan Pembahasan Kimia SBMPTN 2018 Nomer 37 PDF
Download Soal dan Pembahasan Kimia SBMPTN 2018 Nomer 38 PDF
Download Soal dan Pembahasan Kimia SBMPTN 2018 Nomer 40 PDF
Download Soal dan Pembahasan Kimia SBMPTN 2018 Nomer 42 PDF
Download Soal dan Pembahasan Kimia SBMPTN 2018 Nomer 43 PDF
Download Soal dan Pembahasan Kimia SBMPTN 2018 Nomer 44 PDF
Download Soal dan Pembahasan Kimia SBMPTN 2018 Nomer 45 PDF
Download Pembahasan Soal SBMPTN 2018 Kimia Nomer 32 Semua Kode Soal | Bentuk Molekul dan Kepolaran
Sumber aciknadzirah.blogspot.com
EmoticonEmoticon